Peptide: Neurowissenschaftler des MIT haben einen Weg gefunden, die Neurodegeneration und andere Symptome der Alzheimer-Krankheit rückgängig zu machen, indem sie in ein Enzym eingreifen, das in den Gehirnen von Alzheimer-Patienten typischerweise überaktiv ist.
Als die Forscher Mäuse mit einem Peptid behandelten, das die hyperaktive Version eines Enzyms namens CDK5 blockiert, stellten sie eine dramatische Verringerung der Neurodegeneration und der DNA-Schäden im Gehirn fest. Die Mäuse zeigten auch Verbesserungen bei der Bewältigung von Aufgaben wie dem Erlernen des Navigierens in einem Wasserlabyrinth.
„Wir haben festgestellt, dass die Wirkung dieses Peptids einfach bemerkenswert ist“, sagt Li-Huei Tsai, Direktor des Picower Institute for Learning and Memory des MIT und Hauptautor der Studie. „Wir konnten wunderbare Effekte bei der Verringerung der Neurodegeneration und der neuroinflammatorischen Reaktionen feststellen und sogar Verhaltensdefizite beheben.“
Die Forscher hoffen, dass das Peptid nach weiteren Tests schließlich zur Behandlung von Patienten mit Alzheimer und anderen Demenzformen eingesetzt werden könnte, bei denen CDK5 überaktiviert ist. Das Peptid beeinträchtigt nicht CDK1, ein wichtiges Enzym, das CDK5 strukturell ähnlich ist, und es hat eine ähnliche Größe wie andere Peptidmedikamente, die in klinischen Anwendungen eingesetzt werden.
Ping-Chieh Pao, wissenschaftlicher Mitarbeiter am Picower Institut, ist der Hauptautor der Studie, die diese Woche in den Proceedings of the National Academy of Sciences veröffentlicht wurde.
Peptide: CDK5 im Visier
Tsai hat die Rolle von CDK5 bei der Alzheimer-Krankheit und anderen neurodegenerativen Erkrankungen bereits zu Beginn ihrer Karriere untersucht. Als Postdoc identifizierte und klonierte sie das CDK5-Gen, das für eine Art von Enzym kodiert, das als Cyclin-abhängige Kinase bekannt ist. Die meisten anderen cyclinabhängigen Kinasen sind an der Steuerung der Zellteilung beteiligt, CDK5 jedoch nicht. Stattdessen spielt es eine wichtige Rolle bei der Entwicklung des Zentralnervensystems und trägt auch zur Regulierung der synaptischen Funktion bei.
CDK5 wird durch ein kleineres Protein aktiviert, mit dem es interagiert, das als P35 bekannt ist. Wenn P35 an CDK5 bindet, verändert sich die Struktur des Enzyms, so dass es seine Ziele phosphorylieren – also ein Phosphatmolekül anhängen – kann. Bei Alzheimer und anderen neurodegenerativen Erkrankungen wird P35 jedoch in ein kleineres Protein namens P25 gespalten, das ebenfalls an CDK5 binden kann, aber eine längere Halbwertszeit als P35 hat.
Wenn es an P25 gebunden ist, wird CDK5 in den Zellen aktiver. P25 ermöglicht es CDK5 auch, andere Moleküle als die üblichen Ziele zu phosphorylieren, darunter das Tau-Protein. Hyperphosphorylierte Tau-Proteine bilden die neurofibrillären Knäuel, die eines der charakteristischen Merkmale der Alzheimer-Krankheit sind.
In früheren Arbeiten hat das Labor von Tsai gezeigt, dass transgene Mäuse, bei denen die Expression von P25 manipuliert wurde, eine schwere Neurodegeneration entwickeln. Beim Menschen wird P25 mit mehreren Krankheiten in Verbindung gebracht, darunter nicht nur Alzheimer, sondern auch die Parkinson-Krankheit und die frontotemporale Demenz.
Pharmaunternehmen haben versucht, P25 mit niedermolekularen Arzneimitteln zu bekämpfen, aber diese Medikamente haben in der Regel Nebenwirkungen, da sie auch andere zyklinabhängige Kinasen beeinträchtigen, so dass keines von ihnen an Patienten getestet wurde.
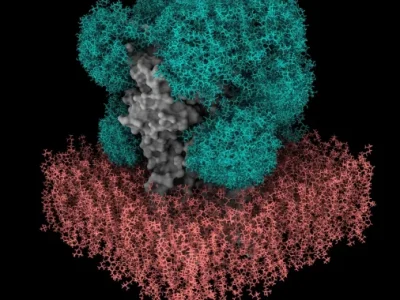
Das MIT-Team entschied sich für einen anderen Ansatz zur Bekämpfung von P25, indem es ein Peptid anstelle eines kleinen Moleküls einsetzte. Sie entwarfen ihr Peptid mit einer Sequenz, die mit einem Segment von CDK5, der so genannten T-Schleife, identisch ist, einer Struktur, die für die Bindung von CDK5 an P25 entscheidend ist. Das gesamte Peptid ist nur 12 Aminosäuren lang – etwas länger als die meisten bestehenden Peptidmedikamente, die fünf bis 10 Aminosäuren lang sind.
„Vom Standpunkt eines Peptidmedikaments aus gesehen, ist kleiner normalerweise besser“, sagt Tsai. „Unser Peptid liegt fast innerhalb dieser idealen Molekülgröße“.
Peptide: Dramatische Auswirkungen
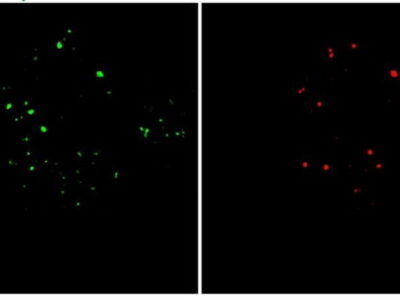
Bei Tests an Neuronen, die in einer Laborschale gezüchtet wurden, stellten die Forscher fest, dass die Behandlung mit dem Peptid zu einer moderaten Verringerung der CDK5-Aktivität führte. Diese Tests zeigten auch, dass das Peptid weder den normalen CDK5-P35-Komplex hemmt, noch andere cyclinabhängige Kinasen beeinflusst.
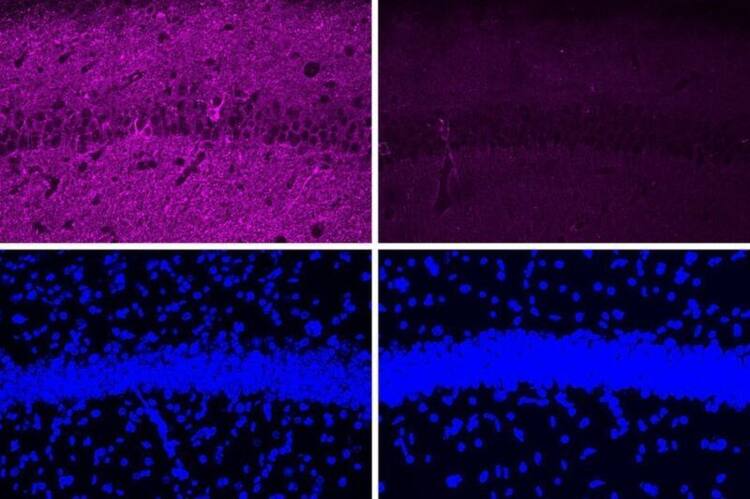
Als die Forscher das Peptid in einem Mausmodell der Alzheimer-Krankheit mit hyperaktivem CDK5 testeten, stellten sie eine Vielzahl positiver Effekte fest, darunter eine Verringerung von DNA-Schäden, neuronalen Entzündungen und Neuronenverlust. Diese Wirkungen waren in den Studien an Mäusen viel ausgeprägter als in Tests an kultivierten Zellen.
Die Peptidbehandlung führte auch zu dramatischen Verbesserungen in einem anderen Mausmodell der Alzheimer-Krankheit, bei dem eine mutierte Form des Tau-Proteins zu neurofibrillären Verwicklungen führt. Nach der Behandlung zeigten diese Mäuse einen Rückgang sowohl der Tau-Pathologien als auch des Neuronenverlusts. Neben diesen Effekten im Gehirn beobachteten die Forscher auch eine Verbesserung des Verhaltens. Mäuse, die mit dem Peptid behandelt wurden, schnitten bei einer Aufgabe, bei der sie lernen mussten, sich in einem Wasserlabyrinth zurechtzufinden, bei der es auf das räumliche Gedächtnis ankommt, wesentlich besser ab als Mäuse, die mit einem Kontrollpeptid behandelt wurden (einer verschlüsselten Version des Peptids, das zur Hemmung von CDK5-P25 verwendet wurde).
In diesen Mäusestudien injizierten die Forscher das Peptid und stellten fest, dass es die Blut-Hirn-Schranke überwinden und Neuronen im Hippocampus und anderen Teilen des Gehirns erreichen konnte.
Die Forscher analysierten auch die Veränderungen in der Genexpression, die in den Neuronen der Mäuse nach der Behandlung mit dem Peptid auftreten. Zu den Veränderungen, die sie beobachteten, gehörte eine Zunahme der Expression von etwa 20 Genen, die typischerweise durch eine Familie von Genregulatoren namens MEF2 aktiviert werden. Das Labor von Tsai hat bereits gezeigt, dass die MEF2-Aktivierung dieser Gene die Widerstandsfähigkeit gegenüber kognitiven Beeinträchtigungen in den Gehirnen von Menschen mit Tau-Tangles erhöhen kann, und sie stellt die Hypothese auf, dass die Peptidbehandlung ähnliche Auswirkungen haben könnte.
Tsai plant nun weitere Studien an anderen Mausmodellen von Krankheiten, die mit P25-assoziierter Neurodegeneration einhergehen, wie frontotemporale Demenz, HIV-induzierte Demenz und diabetesbedingte kognitive Beeinträchtigung.
„Es ist sehr schwer, genau zu sagen, welche Krankheit am meisten profitieren wird, daher denke ich, dass noch viel mehr Arbeit nötig ist“, sagt sie.